由于细胞的活性和再生都伴随着能量的转化,这一转化过程也可以体现在蛋白的磷酸化表达水平上,因此磷酸化水平检测对于判定细胞是否恶性增殖以及诊断癌症有着重要的研究意义。另外由于血液中存在大量蛋白酶,使得无法直接从血液里面提取蛋白并分析磷酸化水平,而外泌体作为一种内源性囊泡结构可以有效保护其内部的蛋白不收蛋白酶影响,因此外泌体的整体蛋白磷酸化表达水平可以作为一种有效的癌症诊断指标。目前已有的分析外泌体蛋白磷酸化表达水平的医学手段例如磷酸化质谱,存在着检测周期长、数据繁杂、测试费用昂贵的弊端,这极大的限制当前外泌体蛋白磷酸化水平相关的医学研究。
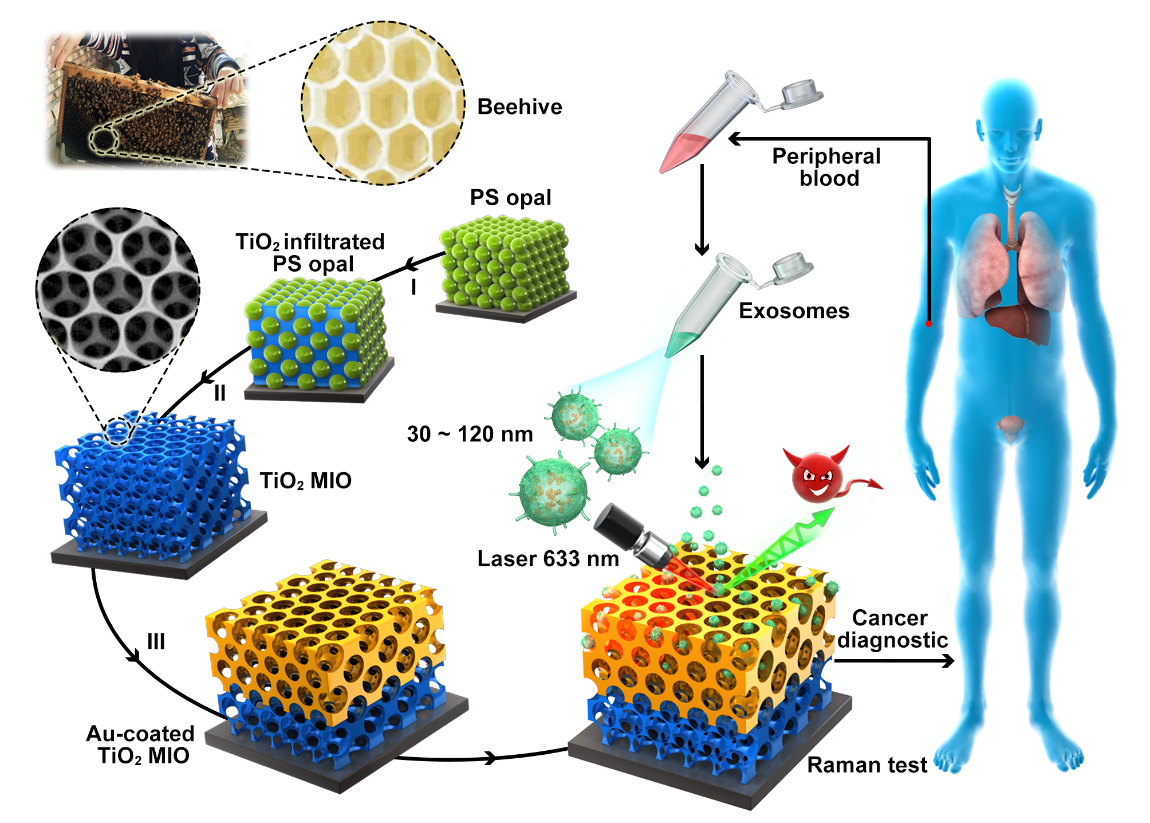
受蜂巢结构能高效吸收声波这一现象的启发,针对于粒径范围为30~120 nm的外泌体设计了一种仿生多孔反蛋白石状(MIO)SERS探针。通过三维有限时域差分理论模拟,证实了本光学检测系统可以把波长为633 nm的Raman激发激光、待检测物外泌体、SERS基底三者完美结合,并将反蛋白石的“慢光效应”和贵金属的表面等离激元效应充分利用,进而获得外泌体囊泡的Raman信号。前期通过对不同程度磷酸化表达的标准蛋白、癌症细胞系和正常细胞系层面的外泌体囊泡进行Raman检测及分析,发现高磷酸化表达的蛋白和多种癌症细胞系的外泌体相对于低磷酸化表达的蛋白和正常细胞系的外泌体在1087 cm-1拉曼峰位处(归属于P-O振动键)都体现出更高的拉曼强度,这初步表明通过观测外泌体样本在1087 cm-1处的拉曼峰强来判断其蛋白磷酸化表达程度。后期我们收集了大量的实际血浆样本(病人:45个前列腺癌/15个肺癌/15个肝癌/8个结直肠癌,正常人:10个),并从中提取外泌体样本进行Raman检测,最终我们发现几乎所有的癌症外泌体样本在1087 cm-1处拉曼强度是正常外泌体样本在1087 cm-1处拉曼强度的至少2倍,这进一步证实了该体系在实际癌症检测中的普适性和准确性。随后的医学western blot 对照分析也印证了光学检测体系的可信度。
本研究通过巧妙设计得到了一种专门针对大颗粒待检测物(外泌体囊泡)的SERS光学检测系统,实现了快速的,非侵入性的,精准的癌症检测,将纳米材料设计和医学检测结合,这在未来的快速癌症预诊断领域也必将有着很广的应用前景。
相关工作(Beehive-Inspired Macroporous SERS Probe for Cancer Detection through Capturing and Analyzing Exosomes in Plasma)近期发表在·ACS Applied Materials & Interfaces上,武汉大学物理科学与技术学院博士研究生董仕练和武汉大学中南医院硕士研究生王宇慧为论文的共同第一作者,武汉大学物理科学与技术学院肖湘衡教授、武汉大学中南医院汪付兵教授和浙江大学材料科学与工程学院杨士宽教授为论文的共同通讯作者。
论文链接:https://pubs.acs.org/doi/10.1021/acsami.9b21333
(通讯员:董仕练)